Рисдиплам
RisdiplamФармакологическое действие
Рисдиплам — модификатор сплайсинга мРНК, препарат для лечения мышечной атрофии позвоночника (SMA). Увеличивает системную концентрацию функциональной выживаемости белка двигательных нейронов, продуцируемого геном SMN2. Механизм действия аналогичен его предшественнику нусинерсену, наибольшее различие заключается в способе его введения: нусинерсен вводится интратекально, рисдиплам — перорально.
Рисдиплам увеличивает включение экзона 7 в транскрипты рибонуклеиновой кислоты (мРНК) SMN2 и продукцию полноразмерного белка SMN в головном мозге.
Данные in vitro и in vivo показывают, что рисдиплам может также вызывать сплайсинг других генов, включая FOXM1 и MADD, которые участвуют в регуляции клеточного цикла и апоптоза, соответственно, что может объяснять ряд неблагоприятных эффектов, наблюдаемых у животных.
Фармакодинамика
Механизм действия
Рисдиплам представляет собой модификатор сплайсинга предшественника матричной рибонуклеиновой кислоты (пре-мРНК) гена выживаемости двигательных нейронов 2 (SMN2), разработанный для лечения спинальной мышечной атрофии (СМА), причиной которой являются мутации в хромосоме 5q, что приводит к недостаточности белка SMN.
Недостаточность функционального белка SMN является патофизиологическим механизмом развития СМА всех типов. Рисдиплам корректирует сплайсинг SMN2, сдвигая баланс с исключения экзона 7 на включение экзона 7 в транскрипте м-РНК. приводя к образованию функционального и стабильного белка SMN. Таким образом, рисдиплам лечит СМА путём увеличения и сохранения уровней функционального белка SMN.
Рисдиплам равномерно распределяется во всем организме, в том числе в центральной нервной системе (ЦНС), проникая через гематоэнцефалический барьер и соответственно приводя к увеличению уровня белка SMN в ЦНС и по всему организму. Концентрации рисдиплама в плазме и белка SMN в крови отражают распределение и фармакодинамические эффекты рисдиплама в тканях, а именно: мышечных тканях и тканях мозга.
Во всех клинических исследованиях применение рисдиплама приводило к устойчивому и длительному увеличению уровня белка SMN. В течение 4 недель после начала лечения медианный уровень белка SMN был более чем в 2 раза выше по сравнению с исходным значением, согласно измерениям в крови. Повышение уровня белка SMN сохранялось на протяжении периода лечения ≤2 лет у пациентов с манифестацией СМА в младенческом возрасте и у пациентов с поздней манифестацией СМА (см. подраздел «Клиническая эффективность»).
Клиническая эффективность
Эффективность рисдиплама для лечения пациентов с манифестацией СМА в младенческом возрасте и пациентов с поздней манифестацией СМА оценивалось в 2 опорных клинических исследованиях FIREFISH и SUNFISH и подтверждено дополнительными данными, полученными в исследовании JEWELFISH. В целом результаты исследований подтверждают эффективность рисдиплама у пациентов со СМА.
Манифестация СМА в младенческом возрасте
ВР39056 (FIREFISH) представляет собой открытое исследование по изучению эффективности, безопасности, фармакокинетики и фармакодинамики рисдиплама у пациентов с симптоматической СМА 1 типа (у всех пациентов было генетически подтверждено заболевание с двумя копиями гена SMN2). Исследование состоит из двух частей. Часть 1 исследования FIREFISH разработана как часть исследования по подбору дозы. В подтверждающей части 2 исследования FIREFISH оценивалась эффективность рисдиплама в терапевтической дозе, которая была выбрана на основании результатов части 1 исследования. Пациенты из части 1 не принимали участия в части 2.
В частях 1 и 2 ключевой конечной точкой по эффективности была возможность сидеть без поддержки в течение, как минимум, 5 секунд согласно измерениям по пункту 22 шкалы развития младенцев и детей Бейли — 3 издание (Bayley Scales of Infant and Toddler Development, BSID-II1, шкала крупной моторики) после 12 месяцев лечения рисдипламом.
FIREFISH часть 2
В часть 2 исследования FIREFISH был набран 41 пациент со СМА 1 типа.
Медиана возраста возникновения клинических признаков и симптомов СМА 1 типа составила 1.5 месяцев (1.0–3.0 месяцев), 54 % были женского пола, 54 % — представители европеоидной расы и 34 % — представители азиатской расы.
Медиана возраста на момент набора в исследование составила 5.3 месяцев (2.2–6.9 месяцев), медиана времени между возникновением симптомов и приёмом первой дозы составила 3.4 месяцев (1.0–6.0 месяцев).
На исходном уровне средний индекс по результатам теста детской больницы Филадельфии для оценки двигательных функций при нейромышечных заболеваниях у новорождённых (Children’s Hospital of Philadelphia Infant Test of Neuromuscular Disorders, CHOP-INTEND) составил 22 балла (8.0–37.0) и средний индекс по результатам неврологической оценки младенцев по шкале Хаммерсмита, модуль 2 (Module 2 of the Hammersmith Infant Neurological Examination, HINE-2) составил 1.0 (0.0–5.0).
Первичной конечной точкой была доля пациентов с возможностью сидеть без поддержки в течение, как минимум, 5 секунд после 12 месяцев терапии (шкала крупной моторики BS1D-11I, пункт 22). Конечные точки по эффективности у пациентов, получавших рисдиплам, сравнивали с таковыми в аналогичных группах нелеченных пациентов с манифестацией СМА в младенческом возрасте с естественным течением заболевания (критерии функционирования) — см. таблицу 1 ниже.
| Конечные точки по эффективности | Доля пациентов N = 41 (90 % ДИ) |
|---|---|
Основные критерии двигательной функции и развития | |
BSID-II1: способность сидеть без поддержки в течение, как минимум, 5 секунд Значение p на основании критерия функционирования 5 %а | 29.3 % (17.8 %, 43.1 %) <0,0001 |
CHOP-INTEND: индекс 40 или выше Значение p на основании критерия функционирования 17 %а | 56.1 % (42.1 %, 69.4 %) <0.0001 |
CHOP-INTEND: увеличение на ≥4 балла по сравнению с исходным уровнем Значение p на основании критерия функционирования 17 %a | 90.2 % (79.1 %, 96.6 %) <0.0001 |
HINE-2: ответившие по основным критериям двигательной функцииb Значение p на основании критерия функционирования 12 %а | 78.0 % (64,8 %, 88.0 %) <0.0001 |
Выживаемость и выживаемость без событий | |
Выживаемость без событийc Значение p на основании критерия функционирования 42 %a | 85.4 % (73.4 %, 92.2 %) <0,0001 |
Живы Значение p на основании критерия функционирования 60 %a | 92.7 % (82.2 %, 97.1 %) 0.0005 |
Глотание и кормление | |
Способность глотать | 85.4 % (73.15 %, 93.43 %) |
Способность принимать пищу через ротd | 82.9 % (70.3 %, 91.7 %) |
Использование ресурсов здравоохранения | |
Отсутствие госпитализацийe | 48.8 % (35.1 %, 62.6 %) |
a Значения р по выживаемости и выживаемости без событий основаны на Z-тестировании; значения p для других конечных точек (BSID-III, CHOP-INTEND, HINE-2) основаны на точном биноминальном тестировании. Доля выживаемости устанавливается с использованием методологии Каплана-Мейера.
b Согласно HINE-2: увеличение на ≥2 балла [или максимальный показатель] для способности брыкаться, ИЛИ увеличение на ≥1 балл по основным критериям двигательной функции: способность держать голову, перекатываться, сидеть, ползать, стоять или ходить И улучшение по большему числу категорий основных критериев двигательной функции по сравнению с ухудшением, что определяется как пациент, ответивший на этот анализ.
c Явлением считается достижение конечной точки по постоянной вентиляции лёгких (трахеостомия или ≥16 часов неинвазивной вентиляции лёгких в течение суток или интубация в течение >21 последовательного дня в отсутствие или после разрешения острого обратимого явления). Три пациента достигли конечной точки по постоянной вентиляции лёгких до 12 месяца. Все 3 пациента достигли увеличения, как минимум, на 4 балла по их индексу CHOP-INTEND по сравнению с исходным уровнем.
d Включает пациентов, которых кормили исключительно через рот (всего 28 пациентов) и пациентов, которых кормили как через рот, так и с помощью трубки для кормления (всего 6 пациентов) на 12 месяце.
e Госпитализации включают все госпитализации, которые длились, как минимум, 2 дня.
После 12 месяцев терапии рисдипламом 29 % (12/41) пациентов соответствовали критерию способности сидеть без поддержки (BSID-III, пункт 22), 93 % (38/41) пациентов были живы и 85 % (35/41) пациентов были живы и без событий (без постоянной вентиляции), см. рисунок 1. Эти результаты указывают на клинически значимое отличие от естественного течения заболевания у нелеченных пациентов с манифестацией СМА в младенческом возрасте. Нелеченные пациенты с манифестацией СМА в младенческом возрасте никогда не смогут сидеть без поддержки, и ожидается, что только 25 % пациентов смогут выжить без постоянной вентиляции лёгких после достижения возраста в 14 месяцев.
Рисунок 1. График Каплана-Мейера выживаемости без событий (FIREFISH часть 1 и часть 2)

+ цензурировано: один пациент в части 2 был цензурирован, поскольку он рано осуществил визит 12 месяца.
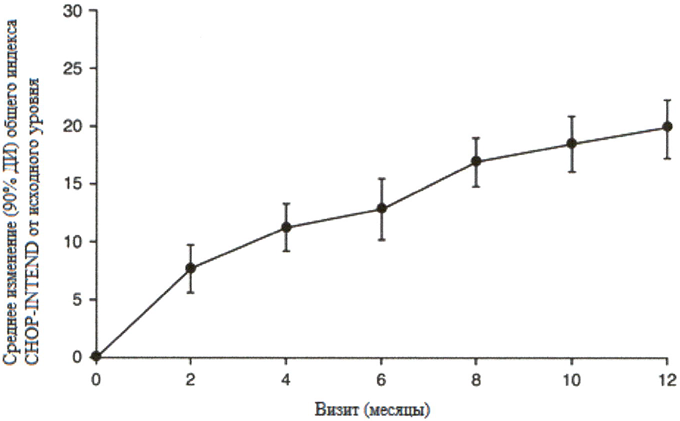
Большинство пациентов достигли ответа по категориям основных критериев двигательной функции HINE-2, включая определённый уровень способности держать голову (76 %, 31/41), сидеть (61 %, 25/41), перекатываться (56 %, 23/41) и стоять (22 %, 9/41). Согласно измерениям общего индекса CHOP-INTEND также наблюдались улучшения двигательной функции, см. рисунок 2.
Рисунок 2. Среднее изменение по сравнению с исходным уровнем общего индекса CHOP-1NTEND (FIREFISH часть 2).
FIREFISH часть 1
Эффективность рисдиплама у пациентов со СМА 1 типа также подтверждается результатами из части 1 исследования FIREFISH. Для 21 пациента из части 1 характеристики на исходном уровне согласовывались с таковыми у пациентов с симптомами со СМА 1 типа.
Медиана возраста включения в исследование составила 6.7 месяцев (3.3–6.9 месяцев); медиана времени между возникновением симптомов и приёмом первой дозы составила 4.0 месяцев (2.0–5.8 месяцев). Всего 17 пациентов получили терапевтическую дозу (дозу, выбранную для части 2) в течение первых 12 месяцев терапии. После 12 месяцев терапии 41 % (7/17) пациентов могли сидеть без поддержки, как минимум, в течение 5 секунд (BSID-III, пункт 22). После 18 месяцев терапии 88 % (15/17) пациентов были живы и без событий (без постоянной вентиляции), см. рисунок 1. Данные результаты по выживаемости и развитию двигательной функции согласовывались с результатами исследования FIREFISH часть 2.
Поздняя манифестация СМА
ВР39055 (SUNFISH) представляет собой многоцентровое исследование по изучению эффективности, безопасности, фармакокинетики и фармакодинамики рисдиплама у пациентов со СМА 2 или 3 типа в возрасте 2–25 лет. Исследование состоит из двух частей. В части 1 осуществлялся подбор дозы. Часть 2 представляла собой рандомизированную, двойную слепую, плацебо-контролируемую, подтверждающую часть исследования. Пациенты из части 1 не принимали участия в части 2.
Первичной конечной точкой было изменение оценочного показателя двигательной функции — 32 (Motor Function Measure-32, MFM32) от исходного уровня на 12 месяце.
Индекс MFM32 позволяет оценить обширный спектр двигательных функций у большого диапазона пациентов со СМА. Общий индекс MFM32 выражают в виде процента (0-100) от максимально возможного, причём более высокий показатель обозначают лучшую двигательную функцию. Индекс MFM32 измеряет двигательную функцию, в частности важные ежедневные двигательные способности. Небольшие изменения в двигательной функции могут привести к значительному приобретению или потере ежедневных двигательных способностей.
SUNFISH часть 2
SUNFISH часть 2 представляет собой рандомизированную, двойную слепую, плацебо- контролируемую часть исследования SUNFISH у 180 не амбулаторных пациентов со СМА 2 типа (71 %) или 3 типа (29 %). Пациентов рандомизировали в соотношении 2:1 в группу лечения рисдипламом в терапевтической дозе или в группу плацебо. Рандомизация была стратифицирована по возрастным группам (2–5 лет, 6–11 лет, 12–17 лет и 18–25 лет).
Медиана возраста пациентов на момент начала лечения составляла 9,0 лет (2–25 лет), а медиана времени между возникновением первых симптомов СМА и приёмом первой дозы составила 102.6 месяцев (1–275). Из 180 пациентов, включённых в исследование, 51 % были женщинами, 67 % — представителями европеоидной расы, и 19 % — представителями азиатской расы.
На исходном уровне у 67 % пациентов выявлен сколиоз (у 32 % пациентов — тяжёлый сколиоз). Среднее значение индекса MFM32 на исходном уровне составляло 46.1, а индекса по Обновлённому модулю оценки функции верхних конечностей (Revised Upper Limb Module. RULM) — 20.1.
В целом, демографические характеристики пациентов на исходном уровне были хорошо сбалансированы между группами рисдиплама и плацебо, за исключением сколиоза (63.3% пациентов в группе рисдиплама в сравнении с 73.3% пациентов в группе плацебо).
Первичный анализ изменения общего индекса MFM32 на 12 месяце по сравнению с исходным уровнем показал клинически и статистически значимое различие между пациентами, получавшими терапию рисдипламом, и пациентами, получавшими плацебо, в исследовании SUNFISH часть 2. Результаты первичного анализа и ключевых вторичных конечных точек представлены в таблице 2 и на рисунках 3 и 4.
| Конечная точка | Рисдиплам (N = 120) | Плацебо (N=60) |
|---|---|---|
Первичная конечная точка | ||
Изменение общего индекса MFM321 на 12 месяце от исходного уровня Среднее значение, рассчитанное по методу НК (95 % ДИ) | 1.36 (0.61, 2.11) | -0.19 (-1.22, 0.84) |
Различие по сравнению с плацебо Расчётное значение (95 % ДИ) Значение р2 | 1.55 (0.30, 2.81) 0.0156 | |
Вторичные конечные точки | ||
Доля пациентов с изменением общего индекса MFM321 на 12 месяце на ≥3 балла от исходного уровня (95 % ДИ) | 38.3 % (28.9, 47.6) | 23.7% (12.0, 35.4) |
Отношение шансов для общего ответа (95 % ДИ) Значение p3,4 с коррекцией (без коррекции) | 2.35 (1.01, 5.44) 0.0469 (0.0469) | |
Изменение общего индекса RULM5 на 12 месяце от исходного уровня Среднее значение, рассчитанное по методу НК (95 % ДИ) | 1.61 (1.00, 2.22) | 0.02 (-0.83, 0.87) |
Различие по сравнению с плацебо Расчётное (95 % ДИ) значение p2,4 с коррекцией (без коррекции) | 1.59 (0.55, 2.62) 0.0469 (0.0028) | |
НК = наименьшие квадраты
1 На основании правила по отсутствующим данным для индекса MFM32 6 пациентов были исключены из анализа (рисдиплам n = 115, контрольная группа плацебо n = 59).
2 Данные анализировали с использованием смешанной модели повторного измерения с общим индексом на исходном уровне, лечением, визитом, возрастной группой, лечением к визиту, а также исходным уровнем к визиту.
3 Данные анализировали с использованием логистической регрессии с общим индексом на исходном уровне, лечением и возрастной группой.
4 Значение p с коррекцией было получено для конечных точек, включённых в иерархическое тестирование, и выделялось на основании всех значений р, полученных для конечных точек в порядке увеличения иерархии до текущей конечной точки. Значение р без коррекции тестировали при уровне значимости 5%.
5 На основании правила отсутствующих данных для индекса RULM из анализа исключили 3 пациентов (рисдиплам n = 119; контрольная группа плацебо, n = 58).
При сравнении с группой плацебо пациенты, получавшие лечение рисдипламом, продемонстрировали значительное улучшение двигательной функции согласно оценке индекса MFM32 (среднее различие составило 1.55 баллов; p = 0.0156) после 12 месяцев лечения. Пациенты в возрасте 2–5 лет, получавшие терапию рисдипламом, продемонстрировали наибольшее улучшение индекса MFM32 по сравнению с контрольной группой плацебо (увеличение на ≥3 балла у 78.1 % в сравнении с 52.9 %).
Пациенты ≥18 лет, получавшие терапию рисдипламом, достигли стабилизации заболевания (изменение от исходного уровня по общему индексу MFM32 составило ≥0 баллов: 57.1 % в сравнении с 37.5 %).
У пациентов со СМА 2 типа и 3 типа, получавших терапию рисдипламом, наблюдалось сопоставимое улучшение по сравнению с исходным уровнем согласно индексу MFM32 (1.54 баллов [95 % ДИ: 0.06, 3.02]; 1.49 баллов [95 % ДИ: -0.94, 3.93] соответственно) по сравнению с контрольной группой плацебо.
Исследование также достигло вторичного независимого исхода двигательной функции, RULM. Согласно RULM отмечались статистически и клинически значимые улучшения в двигательной функции после 12 месяцев лечения по сравнению с исходным уровнем.
Пациенты в возрасте 2–5 лет, получавшие лечение рисдипламом, продемонстрировали наибольшее улучшение индекса RULM (3.41 баллов [95 % ДИ: 1.55, 5.26]), улучшение также отмечалось у пациентов ≥18 лет (1.74 баллов [95 % ДИ: -1.06, 4.53]).
Рисунок 3. Изменение среднего значения общего индекса MFM32 в течение 12 месяцев от исходного уровня (исследование SUNFISH часть 2)1
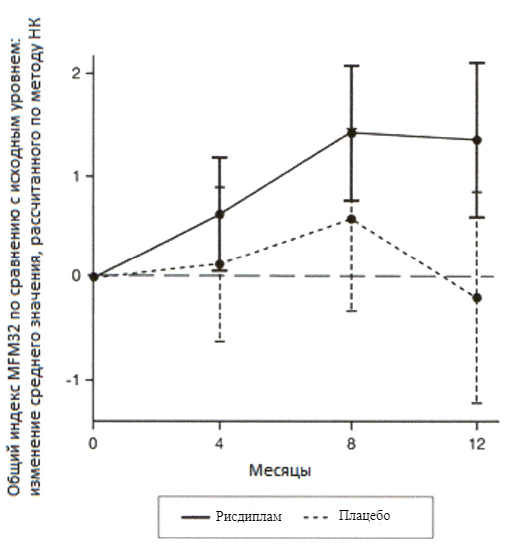
1 Отклонение среднего значения, рассчитанного по методу НК, для изменения по сравнению с исходным уровнем в баллах по индексу MFM32 [95 % ДИ].
Рисунок 4. Изменение среднего значения общего индекса RULM в течение 12 месяцев от исходного уровня (SUNFISH часть 2)1.
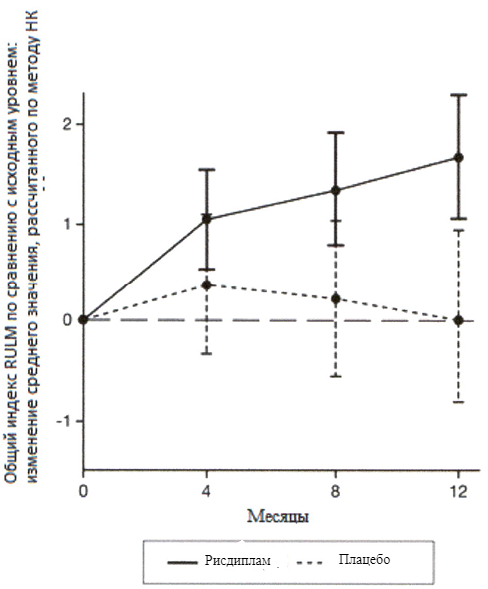
1 Отклонение среднего значения, рассчитанного по методу НК, для изменения по сравнению с исходным уровнем в баллах по индексу RULM [95 % ДИ].
SUNFISH часть 1
Эффективность рисдиплама у пациентов с поздней манифестацией СМА также подтверждается результатами из части 1 (часть исследования SUNFISH по подбору дозы).
В часть 1 был включён 51 пациент со СМА 2 типа и 3 типа (включая 7 амбулаторных пациентов) в возрасте 2–25 лет.
После 1 года лечения препаратом в терапевтической дозе (доза, выбранная для части 2) было отмечено клинически значимое улучшение двигательной функции согласно измерениям индекса MFM32. Среднее изменение по сравнению с исходным уровнем составило 2.7 баллов (95 % ДИ: 1.5, 3.8). Улучшение индекса MFM32 сохранялось ≤2 лет во время лечения рисдипламом (среднее изменение на 2.7 баллов [95 % ДИ: 1.2, 4.2]).
В поисковом анализе двигательную функцию, оцениваемую согласно индексу MFM32, в части 1 исследования SUNFISH сравнивали с группой естественного течения СМА (на основании ключевых прогностических факторов). Общее изменение индекса MFM по сравнению с исходным уровнем после 1 года и 2 лет было выше у пациентов, получавших рисдиплам, по сравнению с группой естественного течения заболевания (после 1 года: различие на 2.7 баллов; p <0.0001; после 2 лет: различие на 4.0 балла; р <0.0001). В группе естественного течения заболевания отмечалось ухудшение двигательной функции, как и ожидалось для естественного прогрессирования СМА (после 1 года: среднее изменение -0.6; после 2 лет: среднее изменение -2.0).
Применение у пациентов, ранее получавших лечение по поводу СМА
ВР39054 (JEWELFISH) представляет собой одногрупповое, открытое исследование по изучению безопасности, переносимости, фармакокинетики и фармакодинамики рисдиплама у пациентов с манифестацией СМА в младенческом возрасте и у пациентов с поздней манифестацией СМА. В исследование были включены пациенты в возрасте 6 месяцев — 60 лет, которые ранее получали лечение по поводу СМА (включая нусинерсен и онасемноген абепарвовек). Из 174 пациентов, включённых в исследование, 76 пациентов ранее получали терапию нусинерсеном (9 пациентов со СМА 1 типа, 43 пациента со СМА 2 типа и 24 пациента со СМА 3 типа) и 14 пациентов ранее получали онасемноген абепарвовек (4 пациента со СМА 1 типа и 10 пациентов со СМА 2 типа). После 4 недель терапии рисдипламом у пациентов отмечалось увеличение уровня белка SMN в крови в среднем ≥2 раза выше по сравнению с исходным уровнем.
Фармакокинетика
Фармакокинетические параметры рисдиплама были изучены у здоровых взрослых добровольцев и у пациентов со СМА.
После приёма рисдиплама в виде раствора внутрь фармакокинетика рисдиплама была приблизительно линейной между 0.6 и 18 мг. Фармакокинетика рисдиплама наилучшим образом описывалась с помощью популяционной фармакокинетической модели со всасыванием с тремя транзитными камерами, двухкамерным распределением и выведением первого порядка. Было обнаружено, что масса тела и возраст оказывают значимое влияние на фармакокинетику.
При применении рисдиплама в терапевтической дозе 0.2 мг/кг один раз в сутки у пациентов с манифестацией СМА в младенческом возрасте (от 2 до 7 месяцев при наборе в исследование) расчётная экспозиция (средняя площадь под кривой «концентрация-время» (AUC)0-24 ч) составила 1930 нг.ч/мл. В исследовании SUNFISH (часть 2) при применении рисдиплама в терапевтической дозе 0.25 мг/кг один раз в сутки у пациентов с массой тела <20 кг и 5 мг один раз в сутки у пациентов с массой тела >20 кг (пациенты с поздней манифестацией СМА от 2 до 25 лет при наборе в исследование), расчётная экспозиция составила 2070 нг.ч/мл. Наблюдаемая максимальная концентрация (средняя Cmax) составила 194 нг.ч/мл при применении в дозе 0.2 мг/кг в исследовании FIREFISH и 120 нг.ч/мл в исследовании SUNFISH часть 2.
Всасывание
Рисдиплам быстро всасывался при приёме натощак, при этом время достижения максимальной концентрации (tmax) в плазме варьировало от 1 до 4 часов после приёма внутрь. Приём пищи (высококалорийный завтрак с высоким содержанием жиров) не оказывал значимого влияния на экспозицию рисдиплама.
Распределение
Установленные популяционные фармакокинетические параметры составили 98 л для кажущегося центрального объёма распределения, 93 л для периферического объёма и 0.68 л/ч для межкамерного клиренса.
Рисдиплам преимущественно связывался с сывороточным альбумином без какого-либо связывания с альфа-1-кислым гликопротеином, свободная фракция составила 11 %.
Метаболизм
Рисдиплам в основном метаболизируется флавин-монооксигеназой 1 и 3 (FMO 1 и 3), а также изоферментами цитохрома (CYP) 1A1, 2J2, ЗA4 и ЗA7.
Одновременный приём итраконазола, мощного ингибитора CYP3A, в дозе 200 мг два раза в сутки с однократным пероральным приёмом рисдиплама в дозе 6 мг не выявил клинически значимого влияния на фармакокинетику рисдиплама (показатель AUC повышен на 11 %, показатель Cmax снижен на 9 %).
Выведение
В ходе популяционного фармакокинетического анализа был установлен кажущийся клиренс (CL/F) рисдиплама 2.6 л/ч.
Эффективный период полувыведения рисдиплама составил приблизительно 50 часов у пациентов со СМА.
Рисдиплам не является субстратом белка множественной лекарственной устойчивости 1 (MDR1) у человека.
Приблизительно 53 % дозы (14 % неизменного рисдиплама) выводилось с калом и 28 % с мочой (8 % неизменного рисдиплама). Исходный препарат был основным компонентом в плазме, что составило 83 % от общих компонентов препарата, находящихся в кровотоке.
Фармакологически неактивный метаболит М1 был определён как основной циркулирующий метаболит.
Особые группы пациентов
Пациенты детского возраста
Масса тела и возраст были определены как ковариаты в популяционном фармакокинетическом анализе. Таким образом, доза определяется в зависимости от возраста (младше и старше 2 лет) и массы тела (до 20 кг) для достижения сходных экспозиций среди пациентов всех возрастов и с различной массой тела. Данные у пациентов младше 2 месяцев отсутствуют.
Пациенты пожилого возраста
Специальных исследований по изучению фармакокинетики рисдиплама у пациентов со СМА старше 60 лет не проводилось. Пациенты со СМА ≤60 лет принимали участие в исследовании JEWELFISH. Субъекты без СМА ≤69 лет принимали участие в клинических исследованиях по фармакокинетике. Согласно результатам данных исследований коррекции дозы у пациентов ≤69 лет не требуется.
Пациенты с нарушением функции почек
Исследований по изучению фармакокинетики рисдиплама у пациентов с нарушением функции почек не проводилось. Рисдиплам в виде неизменного соединения выводится почками в малой степени (8 %).
Пациенты с нарушением функции печени
Нарушение функции печени лёгкой или средней степени тяжести не оказывало влияния на фармакокинетику рисдиплама. После применения 5 мг рисдиплама средние соотношения для Cmax и AUC составили 0.95 и 0.80 у субъектов с нарушением функции печени лёгкой степени тяжести (n = 8), а также 1.20 и 1.08 у субъектов с нарушением функции печени средней степени тяжести (n = 8) по сравнению с соответствующими здоровыми добровольцами (n = 10). Безопасность и фармакокинетика у пациентов с нарушением функции печени тяжёлой степени тяжести не изучались.
Этническая принадлежность
Фармакокинетика рисдиплама у японских субъектов и субъектов европеоидной расы не отличалась.
Показания
Спинальная мышечная атрофия у взрослых и детей в возрасте от 2 месяцев и старше.
Противопоказания
Повышенная чувствительность к рисдипламу, беременность, лактация, возраст младше 2 месяцев.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.Адекватных и хорошо контролируемых исследований о возможности применения рисдиплама у беременных женщин не проведено.
Исследования на животных выявили неблагоприятные последствия (эмбриофетальная смертность, пороки развития, снижение массы тела плода и репродуктивные нарушения у потомства).
У женщин детородного возраста до начала терапии должна быть исключена возможная беременность.
Женщины с репродуктивным потенциалом должны использовать эффективные средства контрацепции во время лечения и в течение как минимум 1 месяца после последней дозы препарата.
Рисдиплам противопоказан при беременности.
Применение в период грудного вскармливания
Специальных исследований о возможности применения рисдиплама в период грудного вскармливания не проведено.
Неизвестно, выделяется ли рисдиплам в грудное человеческое молоко. Экспериментальные исследования показали выделение рисдиплама в молоко лактирующих животных. Риск для грудного ребёнка не может быть исключён.
Фертильность
Лечение рисдипламом может снизить мужскую фертильность.
Рекомендуется предупреждать пациентов мужского пола о потенциальных неблагоприятных репродуктивных эффектах (возможно рассмотрение вопроса о сохранении спермы перед началом лечения). Пациенты-мужчины, которые хотят завести ребёнка, должны прекратить лечение препаратом, как минимум, на 4 месяца. Лечение может быть продолжено после зачатия.
На основании данных доклинических исследований влияния рисдиплама на фертильность у женщин не ожидается.
Контрацепция
Пациенты (мужчины и женщины) репродуктивного потенциала должны соблюдать следующие требования в отношении контрацепции:
- пациенты-женщины детородного потенциала должны использовать высокоэффективные методы контрацепции во время лечения и в течение, как минимум, 1 месяца после приёма последней дозы;
- пациенты-мужчины и их партнёрши детородного потенциала должны вместе использовать высокоэффективные методы контрацепции во время лечения и в течение, как минимум, 4 месяцев после приёма последней дозы пациентом-мужчиной.
Способ применения и дозы
Внутрь 1 раз в день после приёма пищи. Рекомендуемая доза для взрослых и детей массой тела более 20 кг — 5 мг в сутки; для детей массой тела менее 20 кг — 0,2–0,25 мг/кг веса.
Лечение СМА следует начать как можно раньше после постановки диагноза.
Побочные действия
Резюме профиля безопасности
Профиль безопасности рисдиплама основан на трёх клинических исследованиях FIREFISH, SUNFISH и JEWELFISH.
FIREFISH представляет собой открытое исследование, состоящее из двух частей, в которое включено 62 пациента с манифестацией СМА в младенческом возрасте (от 2.2 до 6.9 месяцев). Пятьдесят пять пациентов получали терапию рисдипламом в течение >12 месяцев (см. раздел «Фармакологические свойства», подраздел «Клиническая эффективность»). Нежелательные реакции, которые наблюдались в клинических исследованиях у пациентов с манифестацией СМА в младенческом возрасте, представленные в таблице 5 ниже, основаны на данных объединённого анализа у пациентов из частей 1 и 2 клинического исследования FIREFISH. Нежелательные реакции определяются как нежелательные явления, которые отмечаются у ≥5% пациентов и для которых возможна причинно-следственная связь с рисдипламом.
SUNFISH представляет собой исследование, состоящее из двух частей, в которое включены пациенты с поздней манифестацией СМА (от 2 до 25 лет) (см. раздел «Фармакологические свойства», подраздел «Клиническая эффективность»).
Нежелательные реакции, которые наблюдались в клинических исследованиях у пациентов с поздней манифестацией СМА, основаны на данных исследования SUNFISH часть 2 (n = 180), рандомизированной, двойной слепой, плацебо-контролируемой части исследования с периодом последующего наблюдения, как минимум, 12 месяцев.
Нежелательные реакции определяются как нежелательные явления, которые отмечаются на ≥5% чаще или, как минимум, в 2 раза чаще по сравнению с пациентами, получавшими плацебо, и для которых возможна причинно-следственная связь с рисдипламом.
| Класс систем органов | Нежелательная реакция | Частота N = 62 n (%) | Число явлений/ 100 пациенто-лет Общая экспозиция пациенто-лет = 87.9 | Категория частоты |
|---|---|---|---|---|
| Нарушения со стороны желудочно-кишечного тракта | Диарея | 10 (16.1) | 13.7 | Очень часто |
| Нарушения со стороны кожи и подкожных тканей | Сыпь* | 17(27.4) | 23.9 | Очень часто |
* Включая сыпь, макулопапулёзную сыпь, эритему, дерматит, аллергический дерматит, папулёзную сыпь, фолликулит.
| Класс систем органов | Нежелательная реакция | Частота N = 120 n (%) | Плацебо N = 60 n (%) | Категория частоты |
|---|---|---|---|---|
| Нарушения со стороны желудочно-кишечного тракта | Диарея | 20 (16.7) | 5 (8.3 %) | Очень часто |
| Нарушения со стороны кожи и подкожных тканей | Сыпь* | 20 (16.7) | 1 (1-7) | Очень часто |
Включая сыпь, макулопапулёзную сыпь, эритему, аллергический дерматит, эритематозную сыпь, фолликулит, папулёзную сыпь.
Нежелательные реакции диарея и сыпь отмечались без определённого времени или клинической картины и разрешались несмотря на продолжающееся лечение рисдипламом у пациентов с манифестацией СМА в младенческом возрасте и у пациентов с поздней манифестацией СМА. Данные явления не указывают на влияние на эпителиальные ткани, которые отмечались в исследованиях у животных.
Профиль безопасности у пациентов, ранее получавших терапию по поводу СМА
Профиль безопасности рисдиплама у пациентов, ранее получавших терапию по поводу СМА в исследовании JEWELFISH, сопоставим с таковым у пациентов, ранее не получавших лечения в исследованиях FIREFISH (часть;= 1 и;= 2) и SUNFISH (часть;= 1 и;= 2). В исследовании JEWELFISH принимали участие 76;= пациентов, которые ранее получали нусинерсен и;= 14;= пациентов, которые ранее получали онасемноген абепарвовек (см. раздел «Фармакологические свойства», подраздел «Клиническая эффективность»).
Передозировка
Случаев передозировки в клинических исследованиях не было.
Лечение
Известного антидота для применения в случае передозировки рисдиплама нет.
В случае передозировки следует тщательно наблюдать за пациентом и провести поддерживающую терапию.
Взаимодействие
Рисдиплам в основном метаболизируется флавин-монооксигеназой 1 и 3 (FMO 1 и 3), а также изоферментами цитохрома (CYP) 1A1, 2J2, ЗA4 и ЗA7. Рисдиплам не является субстратом белка множественной лекарственной устойчивости 1 (MDR1) у человека.
Влияние других лекарственных средств на рисдиплам
Одновременный приём итраконазола, мощного ингибитора CYP3A, в дозе 200 мг два раза в сутки с однократным пероральным приёмом рисдиплама в дозе 6 мг не выявил клинически значимого влияния на фармакокинетику рисдиплама (показатель AUC повышен на 11 %, показатель Cmax снижен на 9 %). При одновременном применении ингибитора CYP3A и рисдиплама коррекции дозы последнего не требуется.
Лекарственного взаимодействия с препаратами, метаболизирующимися посредством флавин-монооксигеназы 1 и 3 (FMO 1 и 3), не ожидается.
Влияние рисдиплама на другие лекарственные средства
В условиях in vitro рисдиплам и его основной циркулирующий метаболит М1 не индуцировали CYP1A2, 2B6, 2C8, 2C9, 2C19 или ЗA4. В условиях in vitro рисдиплам и M1 не ингибировали (обратимо или в зависимости от времени) какой-либо из изучаемых ферментов CYP (CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6) за исключением CYP3A.
Рисдиплам является слабым ингибитором CYP3A. При введении препарата рисдиплам здоровым взрослым добровольцам один раз в сутки в течение двух недель экспозиция мидазолама (чувствительного субстрата CYP3A) незначительно повышалась (AUC 11 %, Cmax 16 %). Степень взаимодействия не считается клинически значимой, и, таким образом, коррекции дозы субстратов CYP3A не требуется. Согласно фармакокинетическому моделированию, основанному на физиологии, ожидается, что данный эффект будет иметь сходную выраженность у младенцев старше 2 месяцев и детей.
Исследования in vitro показали, что рисдиплам и его основной метаболит не являются значимыми ингибиторами MDR1, транспортного полипептида органических анионов OATP1B1 и OATP1BЗ и переносчика органических анионов OAT 1 и OAT3 у человека.
Рисдиплам и его метаболит, однако, являются ингибиторами переносчика органических катионов ОСТ2, белка экструзии лекарственных препаратов и токсинов MATE1 и MATE2-K в условиях in vitro. При терапевтических концентрациях препарата взаимодействий с субстратами ОСТ2 не ожидается. Согласно данным, полученным в условиях in vitro, при применении рисдиплама плазменные концентрации препаратов, которые выводятся посредством MATE1 и MATE2-K, могут повышаться.
Клиническая значимость одновременного применения с субстратами MATE1/2-K неизвестна.
Особые указания
Эмбриофетальная токсичность
При изучении применения препарата у животных наблюдалась эмбриофетальная токсичность. Пациенты репродуктивного потенциала должны быть проинформированы о рисках и использовать высокоэффективные методы контрацепции во время лечения и в течение, как минимум, 1 месяца после приёма последней дозы рисдиплама пациентом-женщиной и в течение, как минимум, 4 месяцев после приёма последней дозы рисдиплама пациентом-мужчиной (см. раздел «Беременность и грудное вскармливание»).
Возможное влияние на фертильность у мужчин
Обратимое влияние рисдиплама на мужскую фертильность было показано в исследовании у животных. В связи с этим, пациенты-мужчины не должны быть донорами спермы во время лечения и в течение 4 месяцев после приёма последней дозы рисдиплама (см. раздел «Беременность и грудное вскармливание»).
Нарушение функции печени
Фармакокинетику, безопасность и переносимость рисдиплама в дозе 5 мг оценивали у субъектов с нарушением функции печени лёгкой или средней степени тяжести в специальном клиническом исследовании.
Нарушение функции печени лёгкой или средней степени тяжести не оказывало влияния на фармакокинетику рисдиплама. Таким образом, пациентам с нарушением функции печени лёгкой или средней степени тяжести коррекции дозы не требуется. Применение рисдиплам у пациентов с нарушением функции печени тяжёлой степени тяжести не изучалось (см. раздел «Фармакологические свойства», подраздел «Особые группы пациентов».
Злоупотребление приёмом препарата или лекарственная зависимость
Рисдиплам не обладает потенциалом, который может привести к злоупотреблению приёмом препарата и лекарственной зависимости.
Влияние на способность к вождению автотранспорта и управлению механизмами
Препарат не оказывает влияния на способность управлять транспортными средствами, механизмами.
Классификация
Подробнее по теме
Ознакомьтесь с дополнительной информацией о действующем веществе Рисдиплам:
